Нейродегенеративные заболевания: от молекулярных механизмов к терапии
Место проведения исследований – кафедра нейротехнологий ИББМ, лаборатория по разработке методов нейропротекции НИИ нейронаук и Центр молекулярной биологии и биомедицины ИББМ ННГУ им. Лобачевского.
Руководитель исследования: д.б.н., доц., профессор каф. нейротехнологий, и.о. зав.каф. молекулярной биологии и иммунологии Митрошина Елена Владимировна.

Состав исследовательской группы:
- Ведунова Мария Валерьевна – д.б.н., профессор, директор ИББМ
- Перенков Алексей Дмитриевич – к.б.н., доцент каф. молекулярной биологии и иммунологии
- Клименко Мария Олеговна – преподаватель кафедры общей и медицинской генетики ИББМ
- Михеева Ульяна Александровна – младший научный сотрудник кафедры нейротехнологий
- Марасанова Екатерина Андреевна – аспирант, лаборант-исследователь кафедры нейротехнологий ИББМ
- Новикова Кира Алексеевна, Андронова Екатерина Николаевна, Белов Артем Викторович, Васина Дарья Андреевна, Траханова Анастасия Алексеевна, Бредихина Татьяна Дмитриевна, Штырева Дарья Семеновна – студенты кафедры нейротехнологий ИББМ
- Калинина Елизавета Павловна, Корокозова Мария Вадимовна, Карпенко Екатерина Алексеевна, Кубарева Анастасия Михайловна, Стрелкова Полина Леонидовна – выпускники кафедры нейротехнологий ИББМ
Цель исследования – изучение молекулярных механизмов нейродегенеративных процессов и поиск способов их коррекции, в том числе:
- Изучение роли серотониновой системы, в частности серотониновых рецепторов 5-HT4 и 5-HT7 в нарушении работы нейронных сетей головного мозга и развитии нейродегенеративных процессов, а также сопутствующих депрессивных состояний при болезни Альцгеймера
- Изучение роли регулируемых типов клеточной смерти (некроптоза) в развитии нейродегенерации.
- Изучение возможности коррекции нейродегенеративных процессов при моделировании болезни Альцгеймера и болезни Паркинсона с помощью модуляции активности фактора, индуцируемого гипоксией HIF-1
- Разработка методов коррекции нейродегенеративных процессов методами оптогенетики
Описание исследования
Увеличение продолжительности жизни неизбежно ставит перед обществом задачу продления когнитивного долголетия. Все более актуальным является исследование процессов старения головного мозга и ассоциированных с возрастом нейродегенеративных заболеваний. Современные исследования демонстрируют существенный рост не только числа нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона, но и когнитивных дисфункций, обусловленных физиологическим старением.
Нейродегенеративные заболевания – это сложные по своей природе патологии, включающие множество патогенетических механизмов – нарушения нормальной функции белков (амилоидов, тау-протеинов, синуклеинов и др.), развитие окислительного стресса, нейровоспаления, митохондриальной дисфункции. Именно поэтому поиск эффективных методов терапии нейродегенеративных процессов требует исследований самых разных аспектов нейродегенеративных процессов.
В течение последнего десятилетия растет интерес исследователей к изучению роли серотонинергической нейротрансмиссии в развитии нейродегенерации и поиск возможных подходов к использованию различных типов серотониновых рецепторов как перспективной мишени терапии. Более того, депрессия также является одним из наиболее частых сопутствующих психиатрических состояний при нейродегенеративных заболеваниях, и прежде всего болезни Альцгеймера. Важно иметь в виду, что серотонинергическая система, помимо своей важнейшей роли в регуляции поведения, эмоций и памяти, участвует также в регуляции нейрогенеза, в том числе и во взрослом мозге, регуляции созревания и программируемой гибели нейронов, формировании синапсов.
При выполнении проекта РНФ «Роль серотониновых 5-HT4 и 5-HT7 рецепторов при депрессивных расстройствах и ассоциированных с депрессией когнитивных нарушениях: от молекулярных механизмов к терапии» мы продемонстрировали, что активность 5-HT4 и 5-HT7 рецепторов является значимой для формирования паттерна нейросетевой активности. Более того, нами было показано, что хроническая активация 5-НТ4 рецепторов ведет к увеличению размеров пре- и постсинаптических окончаний. При этом появляются экспериментальные данные о том, что некоторые подтипы 5-НТ-рецепторов, включая 5-HT4 и 5-HT7, участвуют в процессинге β-амилоида и фосфорилирования тау-белков, и, как следствие, формировании нерастворимых агрегатов β-амилоидных бляшек и нейрофибриллярных клубков, являющихся основными гистопатологическими признаками болезни Альцгеймера. Поэтому в ходе дальнейших исследований мы планируем исследовать вклад 5-HT4 и 5-HT7 в развитие нейродегенеративных процессов и поведенческих изменений при моделировании болезни Альцгеймера in vivo и in vitro.
Кроме того, было высказано предположение, что регулируемые формы клеточной смерти, в том числе некроптоз и пироптоз, играют значимую роль в развитии БА, однако ключевые молекулярные механизмы остаются неизвестными. Современные исследования, в том числе и наши эксперименты продемонстрировали ключевую роль клеток глии, а именно астроцитов и микроглии, в нарушениях нейросетевой активности и воспалительного статуса при нейродегенерации. Мы предполагаем, что целенаправленная модуляция некроптоза в глиальных клетках и нейронах может компенсировать или предотвратить нейродегенеративные изменения, возникающие при БА.
Еще одним передовым подходом к коррекции активности нервных клеток является использование методов оптогенетики.Благодаря селективной экспрессии опсинов – экзогенных светочувствительных белков – становится возможным модулировать активность нейронов, внутриклеточные сигнальные пути или экспрессию генов. В ответ на определенные длины волн света опсины индуцируют либо деполяризацию, либо гиперполяризацию клеточной мембраны. Возбуждающие опсины могут быть использованы для стимуляции активности клеток, тогда как ингибирующие опсины могут подавлять таковую. Разработка способов коррекции нарушений работы нейронных сетей с помощью оптогенетических инструментов – одно из передовых направлений нейробиологии.
Используемые методы
Методы, используемые в исследовании, можно условно разделить на in vitro и in vivo исследования.
In vitro исследования мы проводим на первичных культурах нервных клеток, полученных из гиппокампа или коры больших полушарий мышей. В первичных культурах в соответствии с генетически заданной программой формируются нейронные сети и возникает нейросетевая активность, поэтому первичные культуры являются удобным экспериментальным объектом для наблюдения за развитием и изменением активности нейрон-глиальных сетей.
Регистрация биоэлектрической активности с помощью мультиэлектродных матриц позволяет длительно неинвазивно регистрировать внеклеточные потенциалы действия и изучать реструктуризацию нейросетевой активности при различных воздействиях
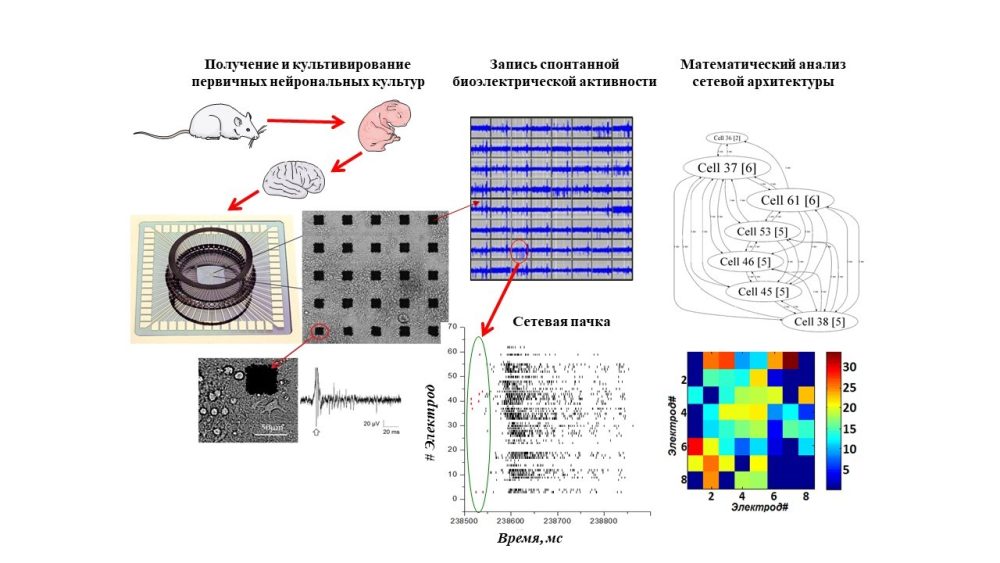
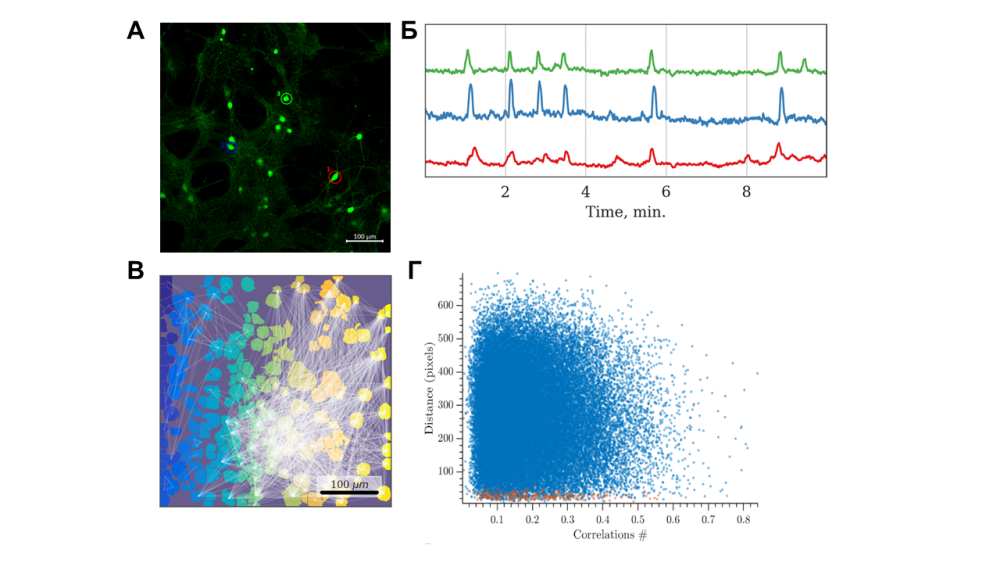
Методами иммуноцитохимии возможно визуализовать различные структуры нервных клеток, рецепторы и т.д.
В исследованиях на животных используются различные поведенческие тесты, позволяющие оценить эмоциональное состояние, двигательную оценку, память и неврологический статус животного.
Для оценки экспрессии целевых генов в различных отделах мозга применяются методы полимеразной цепной реакции в реальном времени (PCR-RT).
Морфологические особенности тканей мозга оценивают с помощью гистологических и иммуногистохимических исследований.

Фото: Екатерина Марасанова, Елена Митрошина
Ключевые публикации на основе исследований за последние 5 лет
- Borsdorf S., Zeug A., Wu Y., Mitroshina E.V., Vedunova M.V., Gaitonde S.A., Bouvier M., Wehr M.C., Labus J., Ponimaskin E. The cell adhesion molecule CD44 acts as a modulator of 5-HT7 receptor functions // Cell Communication and Signaling. V. 22. № 1. 2024. P. 563.
- Mitroshina E.V., Korokozova M.V., Strelkova P.L., Vedunova M.V. The Role of HIF-Prolyl Hydroxylase in Maintaining the Morphological Integrity of the Cerebral Cortex During In Vivo Modeling of Acute Hypobaric Hypoxia // Opera Medica et Physiologica. V. 12. № 2. 2025. P. 74-88.
- Mitroshina E.V., Vedunova M.V. The Role of Oxygen Homeostasis and the HIF-1 Factor in the Development of Neurodegeneration // International Journal of Molecular Sciences. 9. № 25. 2024. P. 4581.
- Mitroshina E.V., Kalinina E.P., Vedunova M.V., Kalyakulina A.I., Teplyakova A.V. The Effect of the Optogenetic Stimulation of Astrocytes on Neural Network Activity in an In Vitro Model of Alzheimer’s Disease // International Journal of Molecular Sciences. V. 25. № 22. 2024. P. 12237.
- Mitroshina E.V., Savyuk M.O., Vedunova M.V. Necroptosis in CNS diseases: Focus on astrocytes // Frontiers in Aging Neuroscience. V. 14. 2023. P. 1016053.
- Klimenko M.O., Mishchenko T.A., Mitaeva Ya.I., Kondakova E.V., Mitroshina E.V., Vedunova M.V. Contribution of Chronic Sleep Deprivation to Age-Related Neurodegeneration in a Mouse Model of Familial Alzheimer’s Disease (5xFAD) // Neurology International. V. 15. № 3. 2023. P. 778-791.
- Mitroshina E.V., Krivonosov M.I., Pakhomov A.M., Yarullina L.E., Gavrish M.S., Mishchenko T.A., Vedunova M.V. Unravelling the Collective Calcium Dynamics of Physiologically Aged Astrocytes under a Hypoxic State In Vitro // International Journal of Molecular Sciences. V. 24. № 15. 2023. P. 12286.
- Mitroshina E.V., Kalinina E.P., Vedunova M.V. Optogenetics in Alzheimer’s Disease: Focus on Astrocytes // Antioxidants. V. 12. № 10. 2023. P. 1856.
- Mitroshina E.V., Marasanova E.A., Vedunova M.V. Functional Dimerization of Serotonin Receptors: Role in Health and Depressive Disorders // International Journal of Molecular Sciences. V. 24. № 22. 2023. P. 16416
- Mitroshina E.V., Loginova M.M., Yarkov R.S., Urazov M.D., Novozhilova M.O., Krivonosov M.I., Ivanchenko M.V., Vedunova M.V. Inhibition of Neuronal Necroptosis Mediated by RIPK1 Provides Neuroprotective Effects on Hypoxia and Ischemia In Vitro and In Vivo // International Journal of Molecular Sciences. V. 23. № 2. 2022. P. 735.
- Mitroshina E.V., Pakhomov A.M., Krivonosov M.I., Yarkov R.S., Gavrish M.S., Vedunova M.V. Novel Algorithm of Network Calcium Dynamics Analysis for Studying the Role of Astrocytes in Neuronal Activity in Alzheimer Disease Models. // International Journal of Molecular Sciences. V. 24. № 23. 2022. P. 15928.
- Mitroshina E.V., Savyuk M.O., Ponimaskin E., Vedunova M.V. Hypoxia-Inducible Factor (HIF) in Ischemic Stroke and Neurodegenerative Disease // Frontiers in Cell and Developmental Biology. № 9. 2021. P. 9:703084.
- Mitroshina E.V., Yarkov R.S., Mishchenko T.A., Kruty V.G., Gavrish M.S., Epifanova E.A., Babaev A.A., Vedunova M.V. Brain-Derived Neurotrophic Factor (BDNF) Preserves the Functional Integrity of Neural Networks in the β-Amyloidopathy Model in vitro // Frontiers in Cell and Developmental Biology. V. 8. № 582. 2020. P. Doi.org/10.3389/fcell.2020.00582.
- Savyuk M.O., Krivonosov M.I., Mishchenko T.A., Gazaryan I., Ivanchenko M.V., Kristichenko A., Poloznikov A., Khuspulyan D., Nikulin S., Tonevitskii E., Abuzarova G., Mitroshina E.V., Vedunova M.V. Neuroprotective Effect of HIF Prolyl Hydroxylase Inhibition in an In Vitro Hypoxia Model // Antioxidants. V. 9. № 8. 2020. P. E662..
- Mitroshina E.V., Krivonosov M.I., Burmistrov D.E., Savyuk M.O., Mishchenko T.A., Ivanchenko M.V., Vedunova M.V. Signatures of the Consolidated Response of Astrocytes to Ischemic Factors In Vitro // International Journal of Molecular Sciences. V. 21. № 21. 2020. P. 7952.
Грантовая поддержка
Грант РНФ 22-15-00178-П «Роль серотониновых 5-HT4 и 5-HT7 рецепторов при депрессивных расстройствах и ассоциированных с депрессией когнитивных нарушениях: от молекулярных механизмов к терапии» 2025-2026, руководитель Митрошина Е.В.
Успешно завершенные гранты
Грант РНФ 22-15-00178 «Роль серотониновых 5-HT4 и 5-HT7 рецепторов при депрессивных расстройствах и ассоциированных с депрессией когнитивных нарушениях: от молекулярных механизмов к терапии» 2022-2024, руководитель Митрошина Е.В.
РФФИ № 18-015-00391 А «Исследование киназ-зависимых механизмов адаптации нервной системы к повреждающим факторам ишемии», 2020-2022 гг. руководитель Митрошина Е.В.
проект в рамках Государственного задания Минобрнауки РФ (базовая часть) № 6.6379.2017/БЧ “Разработка подхода к применению нейротрофического фактора головного мозга для коррекции нейродегенеративных изменений, возникающих при моделировании болезни Альцгеймера”, 2017-2019, руководитель Митрошина Е.В.
Проект Министерства науки и высшего образования Российской Федерации «Создание и развитие научного центра мирового уровня «Центр фотоники» (№ Соглашения 075-15-2020-927 от 13 ноября 2020 г.), 2020-2025 г.,руководитель Иванченко М.В.
Государственное задание Минобрнауки РФ «Молекулярные основы адаптации живых систем» (проект № 0729-2020-0061), 2020-2022 г.г. – руководитель Ведунова М.В.